Neon
Inhoudsopgave
Wat is neon?
Neon (atoomnummer 10, symbool Ne) is een chemisch element en een inert edelgas dat een oranjerode gloed geeft in neonreclames, gloeilampen met een laag voltage en ontladingslampen met een hoog voltage.
Neon is het op een na lichtste edelgas en het heeft het kleinste vloeibare gebied van alle elementen. De vriescapaciteit van neon is 3 keer groter dan die van vloeibaar waterstof en 40 keer groter dan die van vloeibaar helium.
| Symbool | Ne |
| Volledige naam | Neon |
| Atoomnummer | 10 |
| Atoommassa (g.mol-1 ) | 20,183 |
| Groep | Edelgassen |
| Elektronegativiteit (Pauling) | — |
| Dichtheid (g.cm-3 bij 30 °C) | 0,9 * 10-3 |
| Smeltpunt (°C) | -249 |
| Kookpunt (°C) | -246 |
| Vanderwaalsstraal (nm) | 0,16 |
| Ionstraal | — |
| Isotopen | 3 |
| Elektronenconfiguratie | [He]2s2 2p6 |
| Eerste ionisatiepotentiaal (kJ.mol-1 ) | 2080 |
| Tweede ionisatiepotentiaal (kJ.mol-1 ) | 3952 |
| Derde ionisatiepotentiaal (kJ.mol-1 ) | 6122 |
| Ontdekt door | Ramsay en Travers in 1898 |
Neon is een goedkoper koelmiddel dan helium. Neon wordt gebruikt in gloeilampen en in reclameverlichting. Vergeleken met lampen werkt neonverlichting met een hogere spanning en wordt de glazen buis vervormd tot letters en vormen voor bewegwijzering en artistieke en architecturale toepassingen.
Neon wordt ook gebruikt in bliksemafleiders, hoogspanningsindicatoren, vacuümbuizen en helium-neonlasers.
Zowel vloeibaar als gasvormig neon zijn erg duur. De hoge prijs is te verklaren doordat neon alleen uit de lucht kan worden gewonnen.
Neon heeft een kookpunt van -246 °C en een smeltpunt van -249 °C. Het element ontstaat tijdens de fusie van zuurstof en helium. Er zijn sterren met een massa van 3 zonsmassa en een temperatuur van meer dan 100 megaKelvin nodig om neon te kunnen maken.
In massa is neon het vijfde meest voorkomende element in het heelal. Terwijl het overvloedig aanwezig is in het heelal is het op Aarde zeldzaam. Dit komt door de chemische inertie, hoge dampdruk bij lage temperatuur en de relatieve lichtheid. Deze eigenschappen zorgen ervoor dat het element niet gevangen werd in de stofwolken en condenserend gas die resulteerden in het ontstaan van de warmere en kleinere planeten zoals de Aarde.
Neon heeft drie stabiele isotopen: Ne-20, Ne-21 en Ne-22. Neon-20 is het belangrijkste isotoop. In diamanten zijn verhoogde concentraties Neon-20 gemeten en dit suggereert dat er een neonreservoir van de Zon op Aarde aanwezig is.
Wetenschappers hebben blootgesteld aards gesteente onderzocht en aangetoond dat Neon-31 kan ontstaan door middel van kosmische straling. Het ontstaat uit reacties met aluminium, silicium, natrium en magnesium. Dit wijst erop dat neon gebruikt kan worden om er de leeftijd van meteorieten en oppervlaktegesteente mee te bepalen.
Bohr-Rutherford diagram
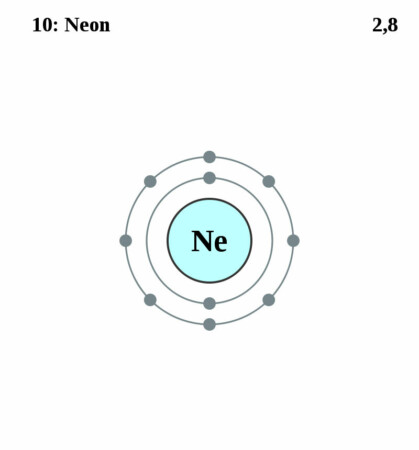
By Pumbaa (original work by Greg Robson) – Application: (generated by script), CC BY-SA 2.0 uk,
Isotopen
| Nummer | Naam | Symbool | Atoommassa (u) | Abundantie (%) |
|---|---|---|---|---|
| 10 | Neon | 20 Ne | 19,992440 | 90,48 |
| 21 Ne | 20,993847 | 0,27 | ||
| 22 Ne | 21,991386 | 9,25 |
Radioisotopen
| Symbool | Atommassa (u) | Halfwaardetijd |
|---|---|---|
| 16 Ne | 16,025761 | 9 * 10−21 s |
| 17 Ne | 17,017672 | 109,2 ms |
| 18 Ne | 18,0057082 | 1,672 s |
| 19 Ne | 19,0018802 | 17,296 s |
| 23 Ne | 22,99446690 | 37,24 s |
| 24 Ne | 23,9936108 | 3,38 min |
| 25 Ne | 24,997737 | 602 ms |
| 26 Ne | 26,000461 | 197 ms |
| 27 Ne | 27,00759 | 32 ms |
| 28 Ne | 28,01207 | 18,3 ms |
| 29 Ne | 29,01939 | 15,6 ms |
| 30 Ne | 30,02480 | 5,8 ms |
| 31 Ne | 31,03311 | 3,4 ms |
| 32 Ne | 32,04002 | 3,5 ms |
| 33 Ne | 33,04938 | <; 260 ns |
| 34 Ne | 34,05703 | 1 ms |
Spectra
Absorptiespectrum
Emissiespectrum
Gezondheid & Gevaren
Neon kan door inademing in het lichaam worden opgenomen en kan in een afgesloten ruimte leiden tot verstikking. Grote concentraties kunnen leiden tot bewusteloosheid, braken, duizeligheid, misselijkheid en uiteindelijk de dood.
De dood is vaak het gevolg van het verlies van bewustzijn, verwarring en beoordelingsfouten die zelfredding verhinderen. Dood en bewusteloosheid kunnen bij lage zuurstofconcentraties binnen enkele seconden optreden. De eerste symptomen zijn een snelle ademhaling en happen naar lucht. De spiercoördinatie is verstoord en de alertheid verminderd. Later worden alle waarnemingen onderdrukt en wort de beoordeling van situaties gebrekkiger. Naarmate de verstikking vordert leidt dot tot braken en misselijkheid, stuiptrekkingen, uitputting en een diepe coma.
Neon is chemisch inert en het is een niet-giftig zeldzaam atmosferisch gas. Het vormt geen verbindingen en het is chemisch niet reactief. Dit betekent dat het geen invloed heeft op de omgeving.