Zink
Inhoudsopgave
Blauw-zilverkleurig zink is een werkpaardelement. Het is cruciaal voor leven en belangrijk in veel industriële processen die vaak onzichtbaar blijven.
Dit metaal staat in het Periodiek Systeem der Elementen op de 30ste plaats en het werd al in de oudheid door de Grieken en Romeinen gebruikt. Maar zink was niet zo populair als koper en ijzer. Het kookt al bij lagere temperaturen dan nodig zijn om het uit erts te winnen dus de oude smelttechnieken waren niet geschikt om zink te isoleren.
Desalniettemin hebben archeologen een handvol zinkartefacten gevonden waaronder een vel zink dat dateert uit 300 voor Christus. Tegenwoordig wordt het metaal voornamelijk gebruikt als coating voor staal en ijzer om roesten te voorkomen. Dit is een proces dat galvanisatie wordt genoemd. Galvanisatie werd al in 1680 toegepast in India. Daar dompelde men bepantsering onder in gesmolten zink.
Chemische gegevens
| Symbool | Zn |
| Volledige naam | Zink |
| Atoomnummer | 30 |
| Atoommassa (g.mol-1 ) | 65,38 |
| Groep | transitiemetalen |
| Elektronegativiteit (Pauling) | 1,65 |
| Dichtheid (g.cm-3 bij 20 °C) | 7,134 |
| Smeltpunt (°C) | 419,5 |
| Kookpunt (°C) | 907 |
| Vanderwaalsstraal (nm) | 0,139 |
| Ionstraal (nm) | 0,074 (+2) |
| Isotopen | 25 waarvan 5 stabiel |
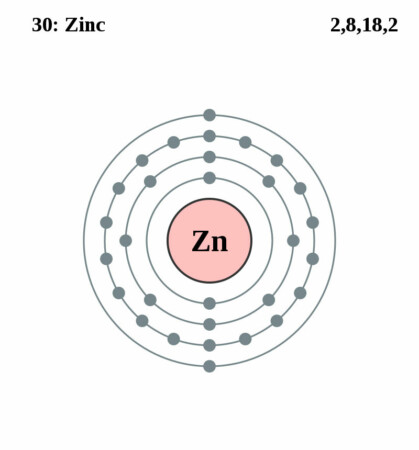
| Elektronenschil | [Ar]3d104s2 |
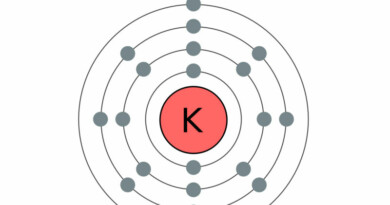
| Elektronen per schil | 2, 8, 18, 2 |
| Eerste ionisatiepotentiaal (kJ.mol-1 ) | 906,4 |
| Tweede ionisatiepotentiaal (kJ.mol-1 ) | 1733,3 |
| Derde ionisatiepotentiaal (kJ.mol-1 ) | 3833 |
| Standaard potentiaal (V) | -0,763 |
| Ontdekt door: | vóór 1000 v. Christus ontdekt door Indiase metallurgisten en in 1746 geïsoleerd door Andreas Marggraf |
Bohr-Rutherford diagram
Isotopen
| Naam | Symbool | Atoommassa (u) | Abundantie (%) |
|---|---|---|---|
| Zink | 64 Zn | 63,929142 | 49,17 |
| 66 Zn | 65,926033 | 27,73 | |
| 67 Zn | 66,927127 | 4,04 | |
| 68 Zn | 67,924844 | 18,45 | |
| 70 Zn | 69,925319 | 0,61 |
radioisotopen
| Symbool | Atoommassa (u) | Halfwaardetijd |
|---|---|---|
| 54 Zn | 53,99295 | onbekend |
| 55 Zn | 54,98398 | 20 ms |
| 56 Zn | 55,97238 | 36 ms |
| 57 Zn | 56,96479 | 38 ms |
| 58 Zn | 57,95459 | 84 ms |
| 59 Zn | 58,94926 | 182,0 ms |
| 60 Zn | 59,941827 | 2,38 min |
| 61 Zn | 60,939511 | 89,1 s |
| 62 Zn | 61,934330 | 9,186(uur |
| 63 Zn | 62,9332116 | 38,47 min |
| 65 Zn | 64,9292410 | 243,66 dagen |
| 69 Zn | 68,9265503 | 56,4 min |
| 71 Zn | 70,927722 | 2,45 min |
| 72 Zn | 71,926858 | 46,5 uur |
| 73 Zn | 72,92978 | 23,5 s |
| 74 Zn | 73,92946 | 95,6 s |
| 75 Zn | 74,93294 | 10,2 s |
| 76 Zn | 75,93329 | 5,7 s |
| 77 Zn | 76,93696 | 2,08 s |
| 78 Zn | 77,93844 | 1,47 s |
| 79 Zn | 78,94265 | 0,995 s |
| 80 Zn | 79,94434 | 545 ms |
| 81 Zn | 80,95048 | 290 ms |
| 82 Zn | 81,95442 | 100 ms |
| 83 Zn | 82,96103 | 80 ms |
Bruikbaar element
Zink werd ontdekt voor het officieel werd ontdekt. In 1746 ontdekte de Duitse chemicus Andreas Marggraf hoe je zink kon isoleren. Marggraf rapporteerde de bevinding tot in detail wat hem de eer opleverde voor de ontdekking, ook al hadden verschillende Europese onderzoekers dezelfde prestatie al volbracht. Een Engelse metallurg, William Champion, had het proces zelfs al jaren eerder gepatenteerd.
Zelfs Champion echter gebruikte technieken die uit de middeleeuwen dateren. Het gebruik van zink in China dateert uit minstens 1637 en het werd zelfs eerder in India gedolven en gesmolten. Volgens onderzoek al in de 9de eeuw. Aanvankelijk gebruikten de mensen in de Oudheid zinkertsen vooral om er messing mee te maken. Messing is een legering van koper met zink. Zink werd in 1374 in India erkent als een op zichzelf staand metaal.
Waar is zink allemaal goed voor? Ongeveer de helft van de 12 miljoen ton die jaarlijks worden geproduceerd wordt gebruikt om te verzinken. Zeventien procent van de jaarlijkse zinkproductie wordt gebruikt om er messing en brons mee te maken en nog eens 17 procent wordt gebruikt om te spuitgieten. De rest gaat naar andere productietoepassingen zoals het maken van dakbedekkingsmaterialen of naar chemische verbindingen zoals zinkoxide. Dit witte poeder komt overal voor, van zonnebrandmiddelen tor zonnecellen en kernreactoren waar het helpt om corrosie te voorkomen.
Zink speelt ook een rol in de gezondheid. Het is een essentieel mineraal dat de enzymen in ons lichaam blij maakt. Een zinktekort kan leiden tot groeistoornissen en verzwakt het immuunsysteem. Enkele van de vreemdste bijwerkingen van een zinktekort zijn afwijkingen in geur en smaak. Zink is namelijk essentieel voor een goede geur en smaak.
Weetjes
- Zink is mogelijk het enige medicijn tegen een normale verkoudheid, althans soort van. Medische studies hebben aangetoond dat als binnen 24 uur na de eerste verkoudheidssymptomen zinktabletten of zinkspray wordt toegediend de duur van de verkoudheid aanzienlijk wordt bekort. Echter deze maatregelen moeten voorzichtig worden genomen want een optimale dosering is niet vastgesteld en een overmaat aan zinkopname via neussprays of neusgels kan leiden tot permanent reukverlies. Het is misschien veel beter om de verkoudheid gewoon uit te zieken.
- Zink komt veel voor in de korst van de Aarde. Per kilogram ongeveer 70 milligram.
- Zinkgluconaat, een zinklegering, kan het dodelijke gif van kwallen neutraliseren. Het zorgt er voor dat kalium niet meer kan weglekken uit bloedcellen.
- Muntgeld bestaat vaak voor een groot gedeelte uit zink.
- De meeste mensen krijgen via het voedsel meer dan voldoende zink binnen. Zinksupplementen kunnen wel nuttig zijn voor vrouwen die last hebben van depressies en irritaties tijdens hun maandelijkse periode. Een supplement met 15 mg zink per dag bleek te leiden tot een lager risico op PMS (PreMenstrueel Syndroom).