Gadolinium
Inhoudsopgave
Wat is Gadolinium?
Gadolinium is een element met atoomnummer 64 en symbool Gd. Het is buigzaam, kneedbaar en het heeft een zilverwitte kleur. Gadolinium behoort tot de lanthaniden oftewel de zeldzame aardmetalen. Van deze groep is het een van de meest voorkomende elementen maar het komt niet in zuivere vorm in de natuur voor. Gadolinium werd in 1880 ontdekt. Het komt voor in het mineraal gadoliniet en daar komt ook de naam van het element vandaan. Gadolinium wordt voornamelijk gewonnen in de Verenigde Staten, China, Australië, Brazilië en Sri Lanka. De wereldreserve wordt geschat op meer dan 1 miljoen ton terwijl er jaarlijks ongeveer 400 ton wordt gewonnen. Net als andere lanthaniden zijn verbindingen met gadolinium gemiddeld giftig. De zouten van gadolinium zijn irriterend voor ogen en luchtwegen en ze veroorzaken mogelijk tumorcellen.
Gegevens
| Symbool | Gd |
| Volledige naam | Gadolinium |
| Atoomnummer | 64 |
| Atoommassa (g.mol-1 ) | 157,26 |
| Groep | Lanthaniden |
| Elektronegativiteit (Pauling) | 1,1 |
| Dichtheid (g.cm-3 bij 20 °C) | 7,9 |
| Smeltpunt (°C) | 1313 |
| Kookpunt (°C) | 3266 |
| Vanderwaalstraal (nm) | |
| Ionstraal (nm) | |
| Isotopen | 7 |
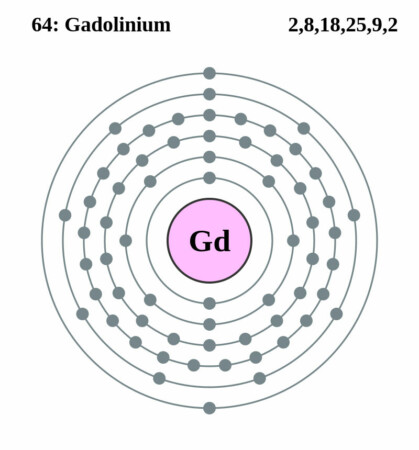
| Elektronenconfiguratie | [Xe]4f75d16s2 |
| Eerste ionisatiepotentiaal (kJ.mol-1 ) | 591,4 |
| Tweede ionisatiepotentiaal (kJ.mol-1 ) | 1165,6 |
| Derde ionisatiepotentiaal (kJ.mol-1 ) | 1991,56 |
| Standaard potentiaal (V) | -2,40 |
| Ontdekt door | Marignac in 1880 |
Bohr-Rutherford diagram
Isotopen
| Nummer | Naam | Symbool | Atoommassa (u) | Abundantie (%) |
|---|---|---|---|---|
| 64 | Gadolinium | 152 Gd | 151,919788 | 0,20 |
| 154 Gd | 153,920862 | 2,18 | ||
| 155 Gd | 154,922619 | 14,80 | ||
| 156 Gd | 155,922120 | 20,47 | ||
| 157 Gd | 156,923957 | 15,65 | ||
| 158 Gd | 157,924101 | 24,84 | ||
| 160 Gd | 159,927051 | 21,86 |
Radioisotopen
| Nuclide | Isotopische massa (u) | Halveringstijd |
|---|---|---|
| 134Gd | 133,95537 | 0,4 s |
| 135Gd | 134,95257 | 1,1 s |
| 136Gd | 135,94734 | 1 s |
| 137Gd | 136,94502 | 2,2 s |
| 138Gd | 137,94012 | 4,7 s |
| 139Gd | 138,93824 | 5,7 s |
| 140Gd | 139,93367 | 15,8 s |
| 141Gd | 140,93212 | 14 s |
| 142Gd | 141,92812 | 70,2 s |
| 143Gd | 142,92675 | 39 s |
| 144Gd | 143,92296 | 4,47 min |
| 145Gd | 144,92170 | 23,0 min |
| 146Gd | 145,91831 | 48,27 dagen |
| 147Gd | 146,91909 | 38,06 uur |
| 148Gd | 147,91811 | 74,6 jaar |
| 149Gd | 148,91934 | 9,28 dagen |
| 150Gd | 149,91865 | 1,79 * 106 jaar |
| 151Gd | 150,92034 | 124 dagen |
| 152Gd | 151,91979 | 1,08 * 1014 jaar |
| 153Gd | 152,92174 | 240,4 dagen |
| 159Gd | 158,92638 | 18,479 uur |
| 161Gd | 160,92966 | 3,646 min |
| 162Gd | 161,93098 | 8,4 min |
| 163Gd | 162,93399 | 68 s |
| 164Gd | 163,93586 | 45 s |
| 165Gd | 164,93938 | 10,3 s |
| 166Gd | 165,94160 | 4,8 s |
| 167Gd | 166,94557 | 3 s |
| 168Gd | 167,94836 | 300 ms |
| 169Gd | 168,95287 | 1 s |
Het element heeft echter een aantal zeer nuttige eigenschappen waardoor toepassing ervan heel goed mogelijk is. Minder dan 1% van het metaal verbetert de stijfheid en verwerkbaarheid van chroom, ijzer en vergelijkbare legeringen. Gadolinium kan zeer veel neutronen absorberen en wordt daarom veel toegepast in kernreactoren. De driewaardige ionen worden verwerkt tot fosforverbindingen die fluorescerende eigenschappen hebben. Iets wat kenmerkend is voor zeldzame aardmetalen.
Bij temperaturen onder 20 °C trekt gadolinium ijzeren objecten aan. Als het binnen een maagneetveld komt dan neemt de temperatuur toe en als het magneetveld wordt verlaten neemt de temperatuur weer af.
In combinatie met andere elementen ontstaan er zogenaamde gadolinium(III)derivaten waaronder boor, stikstof, fosfor en koolstof. Andere derivaten zijn selenium, zwavel, silicium en arseen. In combinatie met vochtige lucht ontstaat er gadolinium(III)oxide.
Als het oxide in salpeterzuur wordt opgelost ontstaat er gadolinium(III)nitraat. Gadolinium is een sterke reductor die de oxides van een aantal elementen kan reduceren tot hun elementen. Gadolinium reageert langzaam met koud water en zeer snel met heet water. Hierbij ontstaat gadoliniumhydroxide. Gadolinium wordt toegepast in kerncentrales. Fosforverbindingen in beeldbuizen bevatten vaak gadolinium. Metallisch gadolinium wordt zelden gebruikt maar legeringen van gadolinium worden gebruikt in de elektronica-industrie en in magneten. Ook worden legeringen gebruikt in opnamekoppen van videorecorders. Ook computergeheugen en CD’s worden gemaakt met behulp van gadolinium.
Gadolinium kent een aantal gespecialiseerde toepassingen waaronder het behandelen van tumoren met neutronentherapie. Ook wordt het element in kernreactoren gebruikt en in door kernenergie aangedreven schepen en onderzeeërs.
Gadolinium heeft 6 stabiele isotopen en 1 radioactief isotoop. In de natuur komt Gd-158 het meeste voor. De andere stabiele isotopen zijn 154Gd, 155Gd, 156Gd, 157Gd en 160Gd. 152Gd is het radioactieve isotoop.