Mangaan
Inhoudsopgave
Mangaan is een heel hard, bros grijswit transitiemetaal dat van nature in verschillende mineralen voorkomt. Mangaan wordt nooit alleen aangetroffen. Het is een van de meest voorkomende elementen in de korst van onze planeet en het bevindt zich wijd verspreid over het oppervlak van de Aarde.
Mangaan is essentieel voor het leven van mens en dier. Het speelt een belangrijke rol in ons metabolisme. Veel legeringen die mangaan bevatten worden gebruikt in de staalproductie, de glasvezelproductie en zelfs om aluminium dat gebruikt wordt voor frisdrankblikjes dunner en sterker te maken.
Chemische gegevens
| Symbool | Mn |
| Volledige naam | Mangaan |
| Atoomnummer | 25 |
| Atoommassa (g.mol-1 ) | 54,938 |
| Groep | transitiemetalen |
| Elektronegativiteit (Pauling) | 1,55 |
| Dichtheid (g.cm-3 bij 20 °C) | 7,21 |
| Smeltpunt (°C) | 1246 |
| Kookpunt (°C) | 2061 |
| Vanderwaalsstraal (nm) | 0,126 |
| Ionstraal (nm) | 0,08 (+2), 0,046 (+7) |
| Isotopen | 22 waarvan 1 stabiel en 21 met een korte halfwaardetijd |
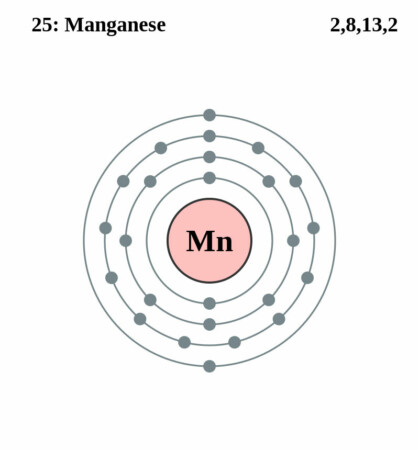
| Elektronenschil | [Ar]3d54s2 |
| Elektronen per schil | 2, 8, 13, 2 |
| Eerste ionisatiepotentiaal (kJ.mol-1 ) | 717,3 |
| Tweede ionisatiepotentiaal (kJ.mol-1 ) | 1509,0 |
| Derde ionisatiepotentiaal (kJ.mol-1 ) | 3248 |
| Standaard potentiaal (V) | -1,05 (Mn2+/Mn) |
| Ontdekt door: | ontdekt in 1774 door Carl Wilhelm Scheele en in 1774 geïsoleerd door Johann Gottlieb Gahn |
Geschiedenis
Mangaan wordt al sinds de oudheid gebruikt. Grotkunstenaars in Frankrijk gebruikten het zwarte erts (mangaandioxide of pyrolusiet) al minstens 30.000 jaar geleden. De Romeinse filosoof Plinius de Oudere schreef in de eerste eeuw na Christus dat het ook werd gebruikt bij het maken van glas. Toevoegen van mangaan maakt het glas helderder. Mangaan werd als zwart pigment aan aardewerk toegevoegd.
In 1740 merkte de Duitse chemicus Johann Heinrich Pott op dat pyrolusiet een nieuw aardmetaal bevatte in plaats van ijzer, zoals algemeen werd aangenomen. In 1770 isoleerde de Oostenrijkse chemicus Gottfried Kaim als eerste mangaan. Het geïsoleerde metaal was onzuiver en verschillende pogingen om mangaan te zuiveren mislukten. De Zweedse chemicus Gottlieb Gahn kwam in 1774 in de buurt toen hij een wit, hard, bros metaal produceerde.
Bohr-Rutherford diagram
Weetjes
- Mangaan is een transitiemetaal en deze metalen zijn taai, vervormbaar en geleiden elektriciteit en warmte.
- Het woord Mangaan komt van het Latijnse woord voor magneten “Magnes”. Mangaan is op zichzelf echter niet magnetisch. In combinatie met aluminium, koper en antimoon zijn de resulterende legeringen echter sterk ferromagnetisch.
- In zuivere vorm is mangaan reactief. Het brandt in zuurstof, roest in water en lost op in verdunde zuren.
- Mangaan komt in zowel oxide als hydroxidevorm veel voor in de bodem.
- Mangaan is het vijfde meest voorkomende element in de korst van de Aarde.
- Mangaan is essentieel voor de fotosynthese en het wordt gebruikt om zuurstof te produceren.
- Omstreeks 1950 werd ontdekt dat mangaan ook essentieel is voor menselijk en dierlijk leven.
- Mangaan is essentieel voor metabolische functies. Het menselijk lichaam bevat 10 tot 20 milligram mangaan. Omdat het niet kan worden opgeslagen in het lichaam moet het constant worden aangevuld door middel van onze voeding.
- Spinazie, thee, sommige kruiden, granen, rijst, sojabonen, eieren, noten, olijfolie, groene bonen en oesters bevatten veel mangaan.
- In het lichaam vinden we mangaan voornamelijk terug in de botten, lever, nieren en de alvleesklier. Het helpt het lichaam bij het aanmaken van bindweefsel, botten, bloedstollingsfactoren en geslachtshormonen.
- Mangaan is ook voor dierlijk leven belangrijk. Sommige soorten, zoals diatomen, weekdieren en sponzen, kunnen mangaan opslaan.
- Teveel mangaan kan echter leiden tot vergiftigingsverschijnselen. Symptomen zijn waanvoorstellingen, vergeetachtigheid, zenuwschade, duizeligheid, zwakke spieren, hoofdpijn en slapeloosheid. Maar een overmaat aan mangaan kan ook leiden tot longembolie, bronchitis, schizofrenie, impotentie bij mannen en zelfs de ziekte van Parkinson.
- Te weinig mangaan daarentegen kan leiden tot overgewicht, glucose intolerantie, bloedstolling, huidaandoeningen, lage cholesterolwaardes, skeletaandoeningen, neurologische symptomen en verkleuringen van het haar.
- Mangaan kan worden gebruikt voor de behandeling van osteoporose, artritis, premenstrueel syndroom, diabetes en epilepsie.
- Omdat mangaan zelf bros is wordt het voornamelijk toegepast in legeringen.
- Mangaan wordt gebruikt om glas helder te maken, om staal te ontzwavelen en ontroesten en om het octaangehalte van benzine te verlagen. Het wordt als zwartbruin pigment in verf gebruikt en als vulstof in batterijen. Aluminium voor frisdrankblikjes kan sterker en dunner worden gemaakt door mangaan toe te voegen.
- De paarse kleur van amethist wordt veroorzaakt door mangaan.
- Mangaan wordt voornamelijk gewonnen in Afrika, Australië, China en Gabon. Het metaal wordt vaak in oxiden aangetroffen en het wordt door middel van reductie met natrium, magnesium of aluminium of door middel van elektrolyse gewonnen.
- Jaarlijks wordt er ongeveer 25 miljoen ton mangaanerts gewonnen. Ongeveer 85-90% van het gewonnen mangaan wordt gebruikt bij de productie van staal.
Huidig onderzoek
Er wordt veel onderzoek gedaan naar de relatie tussen mangaan en gezondheid. Het is bekend dat mangaan essentieel; is voor het goed functioneren van menselijke systemen. Een teveel aan mangaan is slecht voor je en er wordt veel onderzoek gedaan naar blootstelling aan een teveel aan mangaan.
Verschillende studies suggereren dat een verhoogde inname van mangaan via het drinkwater kan leiden tot gedragsproblemen, een verminderd perceptueel redeneren en verminderde geheugenvaardigheden bij kinderen. Deze studies werden allemaal uitgevoerd bij kinderen uit Bangladesh waar relatief veel mangaan (maar ook lood en arseen) in het drinkwater voorkomt.
Spectra
Absorptiespectrum
Emissiespectrum