Platina
Inhoudsopgave
Platina is een zeer gewaardeerd en gewild metaal. Het kent een breed scala aan toepassingen waaronder sieraden, katalysatoren, elektrische contacten, pacemakers, medicatie en magneten. Het is een zeldzaam metaal. Ongeveer 5 ppb van de aardkorst bestaat uit platina. Het is daarom een erg duur element.
Platina is een zilverwit metaal dat ook bekend staat als “witgoud”. Het is buitengewoon goed bestand tegen aanslag en corrosie en het is zeer zacht en gemakkelijk te vervormen. Bovendien is het niet-reactief en dat betekent dat het niet oxideert en niet wordt aangetast door gewone zuren.
Platina is een van de transitiemetalen, dit is een groep waar ook goud, zilver, koper en titanium toe behoren. Ook de meeste elementen in het midden van het periodiek systeem behoren tot de transitiemetalen. Door de atomaire structuur van deze elementen kunnen ze zich gemakkelijk binden met andere elementen.
Platina is ook een van de elementen met de hoogste dichtheid (21,45 gram per cm3). Het is ongeveer 21 keer dichter dan water en ongeveer 6 keer dichter dan een diamant. Deze eigenschappen leiden tot veel verschillende toepassingen van dit zeldzame en kostbare metaal.
Chemische gegevens
| Symbool | Pt |
| Volledige naam | Platina |
| Atoomnummer | 78 |
| Atoommassa (g.mol-1 ) | 195,084 |
| Groep | transitie metaal |
| Elektronegativiteit (Pauling) | 2,28 |
| Dichtheid (g.cm-3 bij 20 °C) | 21,45 |
| Smeltpunt (°C) | 1768,3 |
| Kookpunt (°C) | 3825 |
| Vanderwaalsstraal (nm) | 0,175 |
| Ionstraal (nm) | 0,096 |
| Isotopen | 6 |
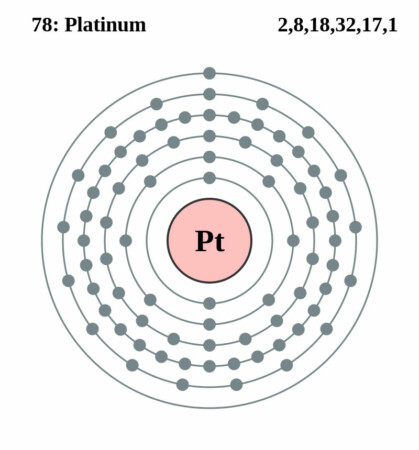
| Elektronenschil | [Xe]4f145d96d1 |
| Elektronen per schil | 2, 8, 18, 32, 17, 1 |
| Eerste ionisatiepotentiaal (kJ.mol-1 ) | 870 |
| Tweede ionisatiepotentiaal (kJ.mol-1 ) | 1791 |
| Derde ionisatiepotentiaal (kJ.mol-1 ) | — |
| Standaard potentiaal (V) | +1,2 (Pt2+/Pt) |
| Ontdekt door: | 1735 door Antonio de Ulloa |
Bohr – Rutherford diagram
Isotopen
| Nummer | Naam | Symbool | Atoommassa (u) | Abundantie (%) |
|---|---|---|---|---|
| 78 | Platinum | 190 Pt | 189,959930 | 0,014 |
| 192 Pt | 191,961035 | 0,782 | ||
| 194 Pt | 193,962664 | 32,967 | ||
| 195 Pt | 194,964774 | 33,832 | ||
| 196 Pt | 195,964935 | 25,242 | ||
| 198 Pt | 197,967876 | 7,163 |
Radioiotopen
| Nuclide | Isotopische massa (u) | Halveringstijd |
|---|---|---|
| 168Pt | 167,98815 | 2,00 ms |
| 169Pt | 168,98672 | 3,7 ms |
| 170Pt | 169,98249 | 14,0 ms |
| 171Pt | 170,98124 | 51 ms |
| 172Pt | 171,97734 | 98,4 ms |
| 173Pt | 172,97644 | 365 ms |
| 174Pt | 173,97281 | 0,889 s |
| 175Pt | 174,97242 | 2,53 s |
| 176Pt | 175,96894 | 6,33 s |
| 177Pt | 176,96846 | 10,6 s |
| 178Pt | 177,96564 | 21,1 s |
| 179Pt | 178,96536 | 21,2 s |
| 180Pt | 179,96303 | 56 s |
| 181Pt | 180,96309 | 52,0 s |
| 182Pt | 181,96117 | 2,2 min |
| 183Pt | 182,96159 | 6,5 min |
| 184Pt | 183,95992 | 17,3 min |
| 185Pt | 184,96062 | 70,9 min |
| 186Pt | 185,95935 | 2,08 uur |
| 187Pt | 186,96059 | 2,35 uur |
| 188Pt | 187,95939 | 10,2 d |
| 189Pt | 188,96083 | 10,87 uur |
| 190Pt | 189,95993 | 6,5 * 1011 jaar |
| 191Pt | 190,96167 | 2,862 dagen |
| 193Pt | 192,96298 | 50 jaar |
| 197Pt | 196,96734 | 19,8915 uur |
| 199Pt | 198,97059 | 30,80 min |
| 200Pt | 199,97144 | 12,5 uur |
| 201Pt | 200,97451 | 2,5 min |
| 202Pt | 201,97574 | 44 uur |
Het “onsmeltbare” metaal
In de oudheid gebruikten mensen in Egypte en Amerika platina om er sieraden en decoratieve stukken mee te maken. Ze mengden het vaak met goud. De eerste geregistreerde verwijzing naar platina komt uit 1557 toen de Italiaanse arts Julius Scaliger een metaal beschreef dat in Midden-Amerika werd gevonden. Dit metaal zou niet smelten. Hij noemde het “platina” en dat betekent “klein zilver”.
In 1741 publiceerde de Britse chemicus Charles Wood een onderzoek waarin hij platina als een nieuw metaal introduceerde. Ook beschreef hij enkele eigenschappen de mogelijke commerciële toepassingen. In 1748 publiceerde de Spaanse wetenschapper en marineofficier Antonio de Ulloa een beschrijving over een metaal dat niet was te bewerken en niet gesmolten kon worden (Hij schreef het oorspronkelijk in 1735 maar zijn papieren werden door de Britse marine destijds in beslag genomen.)
In de 18de eeuw was platina het achtste bekende metaal en was het bekend als “wit goud”. De andere bekende metalen in die tijd waren ijzer, koper, zilver, tin, goud, kwik en lood.
In het begin van de 19de eeuw produceerden de Britse chemici William Hyde Wollaston en Smithson Tennant zuiver platina dat ze hadden geïsoleerd met behulp van een techniek die door Wollaston was ontwikkeld. Hij loste platina op in een mengsel van salpeterzuur en zoutzuur (dat mengsel noemen we aqua regia oftewel koningswater). Nadat het platina gescheiden was van de rest van de oplossing werden later in het residu de elementen palladium, rhodium, osmium, iridium en nog later ruthenium gevonden.
Platina wordt tegenwoordig nog steeds gewonnen met behulp van een techniek die sterk lijkt op die van Wollaston. Materiaal dat platina bevat wordt opgelost in aqua regia en gescheiden van de rest van de oplossing en de nevenproducten en gesmolten op een zeer hoge temperatuur om het zuivere metaal te verkrijgen.
Weetjes
- Platina, iridium, osmium, palladium, ruthenium en rhodium behouden allemaal dat dezelfde groep elementen en ze hebben overeenkomstige eigenschappen. Deze metalen worden vaak gebruikt om zeer duurzame onderdelen te maken voor verschillende machines, gereedschappen en sieraden.
- Platina wordt in verschillende antikankermedicijnen gebruikt. Ongeveer 50% van de patiënten met een kankertherapie gebruikt platina bevattende medicijnen. Sommige van deze medicijnen, zoals cisplatina, worden ook gebruikt om tumoren en kanker bij dieren te behandelen.
- Platina wordt ook gebruikt in pacemakers, tandkronen en andere apparatuur die in het menselijk lichaam wordt gebruikt vanwege zijn corrosiebestendigheid en het gebrek aan reacties met het menselijk lichaam.
- De meerderheid van het gewonnen platina (80% is afkomstig uit Zuid-Afrika. Ongeveer 10% wordt gewonnen in Rusland en de rest komt uit Noord- en Zuid-Amerika. Platina en de andere elementen uit de platinagroep komen niet in grote hoeveelheden voor maar worden vooral gewonnen als bijproduct van de winning van ander metalen.
- Jaarlijks wordt er ongeveer 18 keer meer goud gewonnen dan platina.
- Ongeveer de helft van het gewonnen platina wordt verwerkt in katalysatoren. Het helpt om giftige uitlaatgassen om te zetten naar minder giftige gassen. Platina en de andere platinametalen zijn bestand tegen de zeer hoge temperaturen die nodig zijn voor de oxidatiereacties die de uitstoot verminderen.
- Platina gecombineerd met kobalt zorgt voor zeer sterke permanente magneten. Deze magneten hebben toepassingen in bijvoorbeeld medische apparatuur, motoren, horloges en meer.
- Platina wordt vaak gebruikt als katalysator bij de productie van verschillend oplossingen en bijproducten (die terechtkomen in meststoffen, kunststoffen, brandstofcellen en benzine.
- Veel beleggers kopen en verkopen platina, ook al kan de prijs tijdens de economische groei flink fluctueren en zelfs meer dalen dan de prijzen van andere edelmetalen.
- Ongeveer 30% van het gewonnen platina wordt gebruikt voor juwelen. De beroemdste diamanten ter wereld zijn gezet in platina.
- Het internationale prototype van de kilogram is een cilinder van platina en een platina-iridiumlegering. Deze wordt bewaard in het Internationaal Bureau of Weights and Measures (BIPM) bij Parijs.
Huidig onderzoek
Wetenschappers blijven nieuw toepassingen voor platina vinden. Zo wordt platina bijvoorbeeld gebruikt bij de ontwikkeling van geneesmiddelen tegen kanker.
In 1844 ontdekte de Italiaanse chemicus Michele Peyrone per toeval dat platina anti-neoplastische eigenschappen heeft (dit betekent dat platina de ontwikkeling van tumoren verhinderd). Het onderzoek werd voortgezet en in 1971 werd de eerste menselijke kankerpatiënt behandeld met platinahoudende medicijnen.
Tegenwoordig krijgt ongeveer 50% van de kankerpatiënten behandelingen die dit zeldzame metaal bevatten. Deze geneesmiddelen bevatten onder andere cisplatina, carboplatina en oxaliplatina. Meer medicijnen zijn in ontwikkeling.
Platina is dus een belangrijk onderdeel van medicijnen tegen kanker maar mijnwerkers die het delven moeten we wel heel voorzichtig mee omgaan want het inhaleren of rechtstreeks contact met platinazouten kunnen leiden toe diverse gezondheidsproblemen zoals allergische reacties en schade aan interne organen of zelfs kanker.