Uranium
Inhoudsopgave
Op 6 augustus 1945 viel er een 3 meter grote bom uit de lucht boven de Japanse stad Hiroshima. Minder dan een minuut later was alles binnen anderhalve kilometer van de ontploffing van de bom uitgewist. Een enorme vuurstorm vernietigde snel kilometers meer. Er kwamen tienduizenden mensen om het leven.
Het was het allereerste gebruik van een atoombom in oorlogstijd en het gebruikte één beroemd element om een totale verwoesting aan te richten: uranium. Dit radioactieve element is uniek omdat een van zijn isotopen, uranium-235, de enige natuurlijk voorkomende isotoop is die een kernsplijtingsreactie kan ondergaan. (Een isotoop is een versie van het element met een verschillend aantal neutronen in de kern.)
Om uranium te begrijpen met je radioactiviteit begrijpen. Uranium is van nature radioactief: de kern is instabiel dus het element verkeerd in een constante staat van verval en het is steeds op zoek naar stabiliteit. Uranium was in feite het element dat de ontdekking van radioactiviteit mogelijk maakte. In 1897 liet de Franse natuurkundige Henri Becquerel enkele uraniumzouten achter op een fotografische plaat als onderdeel van een onderzoek baar de invloed van licht op deze zouten. Tot zijn verbazing besloeg de plaat wat duidde op een soort uitstoot van de uraniumzouten.
Bohr-Rutherford diagram
Chemische gegevens
| Symbool | U |
| Volledige naam | Uranium |
| Atoomnummer | 92 |
| Atoommassa (g.mol-1) | 238,02891 |
| Groep | Actiniden |
| Elektronegativiteit (Pauling) | 1,38 |
| Dichtheid (g.cm-3 bij 20 °C) | 19,1 |
| Smeltpunt (°C) | 1132,2 |
| Kookpunt (°C) | 4131 |
| Vanderwaalstraal (nm) | 0,186 |
| Ionstraal (nm) | — |
| Isotopen | 3 natuurlijke isotopen |
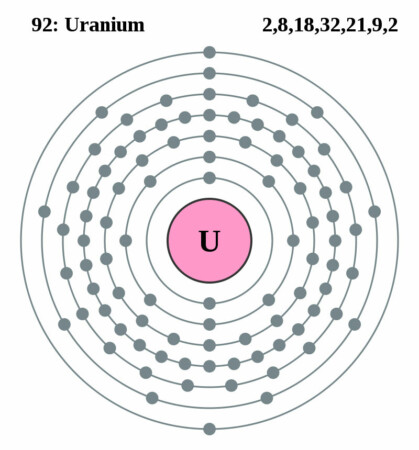
| Elektronen per schil | 2, 8, 18, 32, 21, 9, 2 |
| Elektronenconfiguratie | [Rn]5f36d17s2 |
| Eerste ionisatiepotentiaal (kJ.mol-1 ) | 597,6 |
| Tweede ionisatiepotentiaal (kJ.mol-1 ) | 1420 |
| Derde ionisatiepotentiaal (kJ.mol-1 ) | — |
| Standaard potentiaal (V) | — |
| Ontdekt door | 1789 door Martin Heinrich Klaproth |
Isotopen
| Nummer | Naam | Symbool | Atoommassa (u) | Abundantie (%) |
|---|---|---|---|---|
| 92 | Uranium | 234 U | 234,040946 | 0,0055 |
| 235 U | 235,043923 | 0,7200 | ||
| 238 U | 238,050783 | 99,2745 |
Radioisotopen
| Nuclide | Isotopische massa (u) | Halfwaardetijd |
|---|---|---|
| 217U | 217,02437 | 26 ms |
| 218U | 218,02354 | 6 ms |
| 219U | 219,02492 | 55 ms |
| 220U | 220,02472 | 60 ns |
| 221U | 221,02640 | 700 ns |
| 222U | 222,02609 | 1,4 ms |
| 223U | 223,02774 | 21 ms |
| 224U | 224,02760 | 940 ms |
| 225U | 22,502939 | 61 ms |
| 226U | 226,02933 | 269 ms |
| 227U | 227,03115 | 1,1 min |
| 228U | 228,03137 | 9,1 min |
| 229U | 229,03350 | 58 min |
| 230U | 230,03394 | 20,8 dagen |
| 231U | 231,03629 | 4,2 dagen |
| 232U | 232,03715 | 68,9 jaar |
| 233U | 233,03963 | 1,592 × 105 jaar |
| 234U | 234,04095 | 2,455 × 105 jaar |
| 235U | 235,04392 | 7,04 × 108 jaar |
| 236U | 236,04556 | 2,342 × 107 jaar |
| 237U | 237,04873 | 6,75 dagen |
| 238U | 238,05078 | 4,468 × 109 jaar |
| 239U | 239,05429 | 23,45 min |
| 240U | 240,05659 | 14,1 uur |
| 241U | 241,06033 | 5 min |
| 242U | 242,06293 | 16,8 min |
Geschiedenis van uranium
In 1789 ontdekte de Duitse chemicus Martin Heinrich Klaproth het element uranium. Het was echter al minstens in 79 na Christus bekend toen uraniumoxide werd gebruikt als kleurstof voor keramische glazuren en in glas. Klaproth ontdekte het element in het mineraal pekblende waarvan destijds werd gedacht dat het een zink- en ijzererts was. Het mineraal werd opgelost in salpeterzuur en vervolgens werd er potas (kaliumzouten) aan het resterende neerslag toegevoegd. Klaproth concludeerde dat hij een nieuw element had ontdekt toen de reactie tussen de potas en het neerslag niet overeenkwam met een reactie van een van de bekende elementen. Zijn ontdekking bleek uraniumoxide te zijn en niet zuiver uranium zoals hij aanvankelijk dacht.
Klaproth vernoemde het nieuwe element naar de toen pas ontdekte planeet Uranus. In 1841 zuiverde de Franse chemicus Eugène-Melchior Péligot voor het eerst uranium door uraniumtetrachloride te verhitten in aanwezigheid van kalium.
In 1896 ontdekte de Franse natuurkundige Antoine Henri Becquerel dat uranium radioactief is. Hij had een uraniummonster op een onbelichte fotografische plaat laten liggen en zag dat die plaat troebel werd. Hij concludeerde dat uranium onzichtbare stralen afgeeft. Het was het eerste geval van radioactiviteit en het opende een nieuw wetenschapsgebied. Marie Curie, een Poolse wetenschapper, bedacht de term radioactiviteit kort na de ontdekking van Becquerel en samen met haar man Pierre Curie, een Franse wetenschapper, zette ze het onderzoek voort om andere radioactieve elementen zoals polonium en radium te ontdekken en te bestuderen.
Energie en oorlog
Het uranium in het heelal is ontstaan tijdens supernova-explosies. Op Aarde komt het overal voor. Ongeveer 2 tot 4 ppm van de aardkorst bestaat uit uranium. Het is het 48ste element in de korst van de Aarde. Er komt 40 maal meer uranium voor dan zilver.
Uranium wordt altijd sterk geassocieerd met radioactiviteit maar het verval gaat zo langzaam dat het eigenlijk helemaal niet een van de meest radioactieve elementen is. Uranium-238 heeft een halfwaardetijd van 4,5 miljard jaar. Uranium-235 heeft een halfwaardetijd van iets meer dan 700 miljoen jaar. Uranium-234 heeft de kortste halfwaardetijd van 245.500 jaar maar dit isotoop komt alleen maar voor als verval product van 238U.
Ter vergelijking: polonium is het meest radioactieve element. Het heeft een halfwaardetijd van slechts 138 dagen.
Uranium heeft het vermogen om een nucleaire kettingreactie te ondersteunen. Uranium-235 is splijtbaar en dat betekent dat de kern door thermische neutronen kan worden gespleten. Thermische neutronen hebben dezelfde energie dan hun omgeving. De kern van een 235U-atoom heeft 143 neutronen. Als er een vrij neutron tegen de kern botst dan splitst de kern en werpt extra neutronen af die vervolgens in de kernen van nabijgelegen 235U-atomen kunnen zinken. Op deze manier ontstaat er een zichzelf in standhoudende kettingreactie van kernsplijting. Bij de splijtingsgebeurtenissen komt warmte vrij. In een kernreactor wordt deze warmte gebruikt om water aan de kook te brengen waardoor er stoom ontstaat die een turbine aandrijft om energie op te wekken. De reactie wordt gecontroleerd door materialen als boor en cadmium die extra neutronen kunnen opnemen.
In een kernbom zoals de bom die Hiroshima vernietigde wordt de reactie superkritisch. Dit betekent dat de splijting in een steeds hoger tempo plaatsvindt. Deze superkritische reacties maken enorme hoeveelheden energie vrij: de explosie die Hiroshima vernietigde had een kracht van naar schatting 15 kiloton TNT, allemaal gemaakt met minder dan een kilogram uranium dat aan splijting onderhevig was.
Om uraniumsplijting efficiënter te maken wordt het verrijkt. Natuurlijk uranium bevat slechts 0,7% van de splijtbare isotoop 235U, de rest is 238U. Om het aandeel van 235U te vergroten wordt het uranium vergast of er worden ultracentrifuges gebruikt. Het verrijkte uranium voor kerncentrales bevat gemiddeld tussen 3% en 5% 235U.
Aan de andere kant kennen we ook nog verarmd uranium. Dit wordt gebruikt voor het bepantseren van tanks en om er kogels van te maken. Verarmd uranium is wat er overblijft nadat verrijkt uranium is verbruikt in een kerncentrale. Het is ongeveer 40% minder radioactief dan natuurlijk uranium. Dit verarmde uranium is alleen gevaarlijk als het wordt ingeademd, ingeslikt of in het lichaam terechtkomt bij bijvoorbeeld een explosie of een schietpartij.
Weetjes
Slechts 1,38% van het uranium in de “Little Boy| bom die Hiroshima verwoestte onderging splijting. De bom droeg in totaal 64 kilogram uranium mee.
De bom ontplofte op een hoogte van 50 meter boven Hiroshima. Er bleven in een straal van 1,5 kilometer rond de inslag alleen de skeletten van een paar gebouwen van gewapend beton staan. In een straal van 7 kilometer rond de explosie werd alles door vuurstormen vernietigd.
De halfwaardetijd van 238U is ongeveer 4,5 miljard jaar. Het vervalt in radium-226 en dat vervalt weer naar radon-222. Radon-222 wordt polonium-210 en dat vervalt uiteindelijk tot een stabiel lood isotoop.
Marie Curie werkte met uranium en ze ontdekte o.a. de radioactieve elementen radium en polonium. Ze is vermoedelijk bezweken aan stralingsblootstelling. Ze stierf in 1934 aan een aplastische anemie, een tekort aan rode bloedcellen waarschijnlijk veroorzaakt door stralingsschade aan haar beenmerg.
Zuiver uranium is een zilverkleurig metaal dat aan de lucht heel snel oxideert.
Uranium wordt soms gebruikt om glas te kleuren. Het glas krijgt dan onder een UV-lamp een groengele kleur. Deze kleur wordt overigens niet veroorzaakt door radioactiviteit. De fluorescentie wordt veroorzaakt doordat UV-licht de uranyl-component in glas aanslaat waardoor dit fotonen afgeeft als het weer in zijn grondtoestand terugvalt.
Uranium wordt in veel landen gewonnen. De grootste producenten zijn Canada, Kazachstan, Australië, Niger, Rusland en Namibië.
Alle mensen en dieren worden in het dagelijks leven blootgesteld aan hele kleine hoeveelheden uranium. Dit uranium bevindt zich in ons voedsel, water, bodem en lucht. Deze hoeveelheden zijn voor mensen onschadelijk.
Spectra
Absorptiespectrum
Emissiespectrum
Laatste update: 05/30/2021