Definities en basistermen in de titrimetrie
Inhoudsopgave
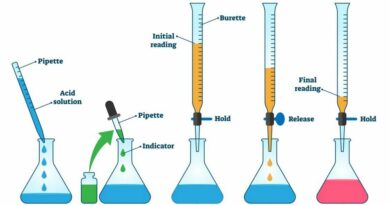
Titrimetrie is ook bekend als titraties of volumetrische analyses. Het is de methode waarbij een oplossing aan een andere oplossing wordt toegevoegd onder omstandigheden waarin het toegevoegde volume betrouwbaar kan worden bepaald. In de kwantitatieve analytische chemie wordt deze methode gebruikt om de onbekende concentratie van een analyt te meten.

Titraties worden vaak in verband gebracht met zuur-basereacties, hoewel het ook om andere soorten reacties kan gaan zoals precipitatie, redox en complexometrische titraties. Meestal wordt een indicator gebruikt om aan te geven dat de reactie is voltooid.
Wat is de definitie van een titratie?
Een titratie wordt gedefinieerd als “een techniek/proces voor het bepalen van de concentratie van een analyt met behulp van de kleinste hoeveelheid reagens met een bekende concentratie die nodig is om een specifiek effect te bereiken wanneer gereageerd wordt met een bekend volume van de testoplossing.”
Wat zijn de termen die bij titraties worden gebruikt?
Buret
Een glazen buis met een schaalverdeling en een kraantje aan één uiteinde. Wordt gebruikt voor titraties om bekende volumes vloeistof toe te dienen.
Conische kolf of erlenmeyer
Een erlenmeyer is een bepaald type laboratoriumkolf met een cilindrische hals, een conisch lichaam en een vlakke bodem. In chemische laboratoria worden conische kolven vaak gebruikt om vloeistoffen in te bewaren en ze te mengen door te zwenken.
Titrant
In de buret wordt een oplossing met een bekende concentratie gedaan die aan een andere oplossing wordt toegevoegd om de concentratie van een tweede chemische stof te bepalen.
Titrand
Een titrand is een oplossing waarvan de concentratie door middel van een titratie wordt bepaald. Het is mogelijk de analytconcentratie te berekenen door de analyt te laten reageren met een titrant van bekende concentratie en volume.
Analyt
Een stof waarvan de hoeveelheid of concentratie moet worden bepaald; bij de bereiding van de analyt wordt de te bepalen stof opgelost in een oplosmiddel.
Indicator
De indicator is een stof die van kleur verandert wanneer deze in zure of alkalische oplossingen wordt gebracht. De kleurindicatoren worden gebruikt om de pH te bepalen en ze kunnen ook aan het reactiemengsel worden toegevoegd om uit te zoeken waar het eindpunt of equivalentiepunt ligt voor de verschillende soorten titraties.
Fenolftaleïne, methyloranje, eriochroom zwart T, methyleenblauw, kaliumpermanganaat, kaliumchromaat, dichlorofluoresceïne, ijzerionen, etc. zijn voorbeelden van indicatoren.
Standaardisatie
Standaardisatie is een titratieproces dat wordt gebruikt om de precieze concentratie (molariteit of normaliteit) van een bereide oplossing te bepalen met behulp van een primaire of secundaire standaardoplossing. Voor het standaardisatieproces is een standaardoplossing essentieel.
Standaardoplossing
Een standaardoplossing is een oplossing waarvan de concentratie van een stof nauwkeurig bekend is. Een bekende hoeveelheid stof wordt opgelost om een bepaald volume te krijgen. Ze wordt bereid met een standaardstof (primaire standaard).
Primaire standaard
Een primaire standaard is een uiterst zuivere verbinding die wordt gebruikt als referentiemateriaal bij titraties, kwantitatieve analyses en andere analytische chemische technieken. Een primaire standaard is representatief voor het molecuulgewicht van de stof en kan gemakkelijk worden gewogen.
Primaire standaarden worden gewoonlijk gebruikt om standaardoplossingen te bereiden. Een primaire standaard is zeer zuiver, niet hygroscopisch, heeft een hoog equivalent gewicht, een lage reactiviteit en is niet giftig.
Secundaire standaard
Een stof waarvan het gehalte aan werkzame stoffen is vastgesteld door vergelijking met de primaire standaard wordt een secundaire standaard genoemd.
Analytische instrumenten en procedures worden gekalibreerd met behulp van secundaire standaardoplossingen.
Equivalentiepunt of stoichiometrisch punt
Het equivalentiepunt of stoichiometrisch punt is het precieze punt in een titratie waarop de mol van een titrant gelijk is aan de mol van de stof die wordt gemeten. Het is een punt in een titratie waarop de reactie tussen de getitreerde stof en de titrant (standaard) is voltooid.
Eindpunt
Het eindpunt is wanneer het aantal mol van de reagerende titrant meer is dan het aantal mol van de onderzochte stof. Dit is het punt in het titratieproces waarop de indicator van kleur verandert.
Buffer
Een oplossing bestaande uit een zuur en zijn geconjugeerde base die wordt gebruikt om de pH van een oplossing te regelen. Het kan kleine hoeveelheden toegevoegd zuur of base neutraliseren waardoor de pH van de oplossing relatief stabiel blijft. Bij EDTA-titraties word teen bufferoplossing gebruikt omdat deze bestand is tegen veranderingen in pH die zich tijdens het proces voordoen.
pH
pH staat voor de waterstofpotentiaal, een maat voor de concentratie waterstofionen en is gelijk aan – log [H+]. De pH-schaal loopt meestal van 0 tot 14. Stoffen met een pH-waarde van minder dan 7 worden als zuur beschouwd en basische of alkalische stoffen hebben een pH-waarde van meer dan 7. pH=7 wordt als neutraal beschouwd.
pKa-waarde
de pKa-waarde beschrijft de zuurgraad van een bepaald molecuul. De sterkte van een zuur wordt bepaald door hoe sterk een proton wordt vastgehouden door een Bronsted-zuur. Wanneer de pKa-waarde laag is, is het zuur sterker en heeft het een groter vermogen om zijn protonen af te staan.
Titratiecurve
Een titratiecurve is de plot van de pH van een analytische oplossing tegen de hoeveelheid titrant die wordt toegevoegd naarmate de titratie vordert. De pH-curves helpen ook bij het bepalen van de sterkte van het zuur/base voor het bepalen van het equivalentiepunt. Bovendien kan de concentratie van de analyt worden bepaald.
Normaliteit
Normaliteit kan worden gedefinieerd als het aantal grammen of mol equivalenten van een opgeloste stof dat aanwezig is in één liter van een oplossing. Wanneer we het hebben over een equivalent dan bedoelen we het aantal mol reactief in een verbinding. He tis het aantal grammen opgeloste stof in één liter (1000 ml) oplossing, aangeduid als N.
Molariteit
De term “molariteit” verwijst naar het aantal mol van de opgeloste stof in één liter (1000 ml) oplossing. Molariteit wordt aangeduid met M en wordt ook wel de molaire concentratie van een oplossing genoemd.
Assay
Een techniek om een stof te analyseren om de samenstelling of kwaliteit ervan vast te stellen wordt een assay genoemd. Een assay is een test die bepaald welke verbindingen een stof bevat. Het wordt vaak gebruikt om de zuiverheid van een stof te bepalen.
Eerste publicatie: 25 maart 2023