Argon
Inhoudsopgave
Wat is Argon?
Argon heeft atoomnummer 18 en symbool Ar. Het is het op twee na meest voorkomende gas op Aarde. Er is dus meer Argon dan koolstofdioxide op Aarde. Het woord “argon” betekent inactief, inert in het Grieks en dat verwijst naar het feit dat argon een edelgas is en slechts met een paar elementen reageert. Argon heeft 8 elektronen in zijn buitenste schil en dat zorgt ervoor dat het een erg stabiel element is dat bestand is tegen reacties.
Argon is een kleurloos en geurloos gas dat in kleine hoeveelheden in de atmosfeer voorkomt. Het vormt geen chemische verbindingen en het is zwaarder dan lucht.
| Symbool | Ar |
| Volledige naam | Argon |
| Atoomnummer | 18 |
| Atoommassa (g.mol-1 ) | 39,948 |
| Groep | Edelgassen |
| Elektronegativiteit (Pauling) | — |
| Dichtheid (g.cm-3 bij 20°C) | 1,78 * 10-3 |
| Smeltpunt (°C) | -189 |
| Kookpunt (°C) | -185,7 |
| Vanderwaalstraal (nm) | 0,192 |
| Ionstraal (nm) | — |
| Isotopen | 3 |
| Elektronenconfiguratie | [Ne]3s2 3p6 |
| Eerste ionisatiepotentiaal (kJ.mol-1) | 1520,58 |
| Tweede ionisatiepotentiaal (kJ.mol-1 ) | 2665,88 |
| Derder ionisatiepotentiaal (kJ.mol-1 ) | 3930,84 |
| Ontdekt door | Ramsay in 1894 |
Isotopen
| Atoomnummer | Naam | Symbool | Atoommassa (u) | Abundantie (%) |
|---|---|---|---|---|
| 18 | Argon | 36 Ar | 35,967546 | 0,3365 |
| 38 Ar | 37,962732 | 0,0632 | ||
| 40 Ar | 39,962382 | 99,6003 |
Radioisotopen
| Symbool | Atoommassa (u) | Halfwaardetijd |
| 30 Ar | 30,02156 | < 20 ns |
| 31 Ar | 31,01212 | 14,4 ms |
| 32 Ar | 31,9976380 | 98 ms |
| 33 Ar | 32,9899257 | 173,0 ms |
| 34 Ar | 33,9802712 | 844,5 ms |
| 35 Ar | 34,9752576 | 1,775 s |
| 36 Ar | 35,967545106 | stabiel |
| 37 Ar | 36,96677632 | 35,04 dagen |
| 38 Ar | 37,9627324 | stabiel |
| 39 Ar | 38,964313 | 269 jaar |
| 40 Ar | 39,9623831225 | stabiel |
| 41 Ar | 40,9645006 | 109,61 min |
| 42 Ar | 41,963046 | 32,9 jaar |
| 43 Ar | 42,965636 | 5,37 min |
| 44 Ar | 43,9649240 | 11,87 min |
| 45 Ar | 44,9680400 | 21,48 s |
| 46 Ar | 45,96809 | 8,4 s |
| 47 Ar | 46,97219 | 1,23 s |
| 48 Ar | 47,97454 | 0,48 s |
| 49 Ar | 48,98052 | 170 ms |
| 50 Ar | 49,98443 | 85 ms |
| 51 Ar | 50,99163 | 60 ms |
| 52 Ar | 51,99678 | 10 ms |
| 53 Ar | 53,00494 | 3 ms |
Bohr-Rutherford diagram
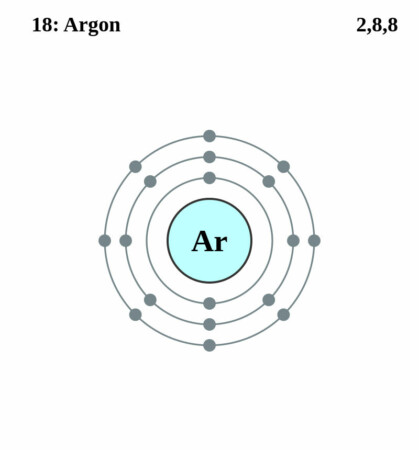
By Pumbaa (original work by Greg Robson) – Application: (generated by script), CC BY-SA 2.0 uk,
Spectra
Absorptiespectrum
Emissiespectrum
Ontdekking
Argon werd in 1894 in Schotland door Sir William Ramsay en Lord Rayleigh voor het eerst geïsoleerd. Zij waren tot de conclusie gekomen dat er naast stikstof nog een ander gas in de lucht was. De stikstof die zij uit chemische verbindingen kregen was namelijk iets lichter dan de stikstof die ze uit de lucht haalden. Ze voerden een experiment uit waarbij ze alle kooldioxide, zuurstof, water en stikstof uit de lucht verwijderden. Argon was het eerste edelgas dat werd ontdekt. Tot 1957 had argon het symbool A.
Argon wordt geproduceerd door het destilleren van vloeibare lucht. Vloeibare lucht is lucht waarvan de temperatuur is verlaagd tot beneden het vriespunt, er wordt dan een blauwachtige vloeistof verkregen.
De meest voorkomende toepassing van argon is als afscherming in industriële processen bij hoge temperaturen. Het is op deze manier erg nuttig omdat de inertheid ervan garandeert dat de lasser of wat voor werk dan ook in een omgeving met hoge temperatuur, wordt beschermd. Argon voorkomt verbranding van grafiet en wordt daarom ook gebruikt in elektrische grafietovens. Ook wordt argon toegepast in gloei- en TL-verlichting.
Argon wordt gebruikt als er een inert gas nodig is. Argon is een goedkoop alternatief voor stikstof. Het element wordt ook gebruikt wanneer een laag warmtegeleidend vermogen nodig is en wanneer elektronische eigenschappen (bijvoorbeeld een emissiespectrum of ionisatie) nodig zijn. Terwijl andere edelgassen hetzelfde doel kunnen doen is argon het goedkoopste edelgas om te gebruiken. Argon is een bijproduct van de productie van zowel stikstof als zuurstof, waarbij een cryogeen luchtscheidingsapparaat wordt gebruikt. Beide gassen hebben een grootschalig industrieel gebruik. Daarnaast is het element in vloeibare vorm gebruikt bij het zoeken naar donkere materie.
Argon is het edelgas dat gebruikt wordt als er met luchtgevoelige materialen wordt gewerkt. Argon wordt ook gebruikt bij de verwerking van reactieve elementen zoals titanium en bij het metaalbooglassen en het wolfraambooglassen. Bij deze processen zijn stikstof en zuurstof niet gewenst omdat ze het materiaal kunnen beschadigen.
Argon wordt ook gebruikt om branden te blussen en schade aan apparatuur te voorkomen.