Astatine
Inhoudsopgave
Astatine is het meest zeldzame element op Aarde. Er komt slechts 25 gram van nature voor op Aarde. Het bestaan van Astatine werd al in de jaren 1800 voorspeld maar het werd pas 70 jaar later ontdekt. Tientallen jaren na zijn ontdekking is er nog steeds heel weinig over Astatine bekend. Veel van de eigenschappen, zoal radioactieve eigenschappen, geleiding en kleur, zijn afgeleid van andere leden van de halogenengroep.
Geschiedenis
In 1869 stelde Dmitri Mendeleev het periodiek systeem op dat we tegenwoordig nog steeds gebruiken. Hij voorspelde eigenschappen van het onbekende element dat positie 85 in het periodiek systeem moest opvullen. Mendeleev noemde dit onbekende element eka-jodide omdat het recht onder jodium in de halogenengroep staat.
Toen de zoektocht naar het nieuwe element begon werden er verschillende rapporten over element 85 gepubliceerd. Onder die rapporten beweringen van onderzoekers dat element 85 helemaal niet kon bestaan, rapporten van onderzoekers die het element vonden het niet konden isoleren en gerapporteerde eigenschappen die niet consistent waren met de testen.
Er bestaat veel onduidelijkheid over wie Astatine als eerste ontdekte. Die ontdekking kan eigenlijk worden toegeschreven aan een handvol onderzoekers.
In 1931 was het Fred Alliston van het Alabama Polytechnic Institute die als eerste claimde het mysterieuze element te hebben gevonden. Alliston stelde voor om het element “Alabamine” te noemen. Echter geen enkele andere wetenschapper kon de resultaten van Alliston reproduceren en er werden ook verschillende fouten gevonden in zijn instrumenten. De ontdekking was echter wel al opgenomen in enkele leerboeken voor studenten.
In 1938 publiceerden Horia Hulubei en Yvetter Cauchois van de Sorbonne universiteit van Parijs hun ontdekking van element 85. Ze gebruikten een chemische scheidingstechniek en ze publiceerden dat ze drie röntgenspectraallijnen hadden gevonden voor het element die overeen kwamen met eerdere voorspellingen. De uitbraak van de Tweede Wereldoorlog verstoorde hun onderzoek en zorgde er ook voor dat hun ontdekking niet wereldwijd bekend werd.
De eerste met succes erkende ontdekking van Astatine was in 1940 en werd gedaan door Dale Coscon, Kenneth Mackenzie en Emilio Segrè, allen onderzoekers aan de universiteit van Californië in Berkeley. Omdat niemand het zeldzame element in de natuur had kunnen vinden produceerde deze grep wetenschappers het kunstmatig door 209Bismut te bombarderen met alpha-deeltjes. Ze deden dit in een deeltjesversneller. Deze reactie creëerde zowel 211Astatine als twee vrije neutronen. Het element was zeer radioactief en instabiel. Dit leidde tot de naam Astatine die van het Griekse woord voor instabiel is afgeleid.
Begin jaren ’40 identificeerde en karakteriseerde nog een andere groep wetenschappers element 85. Berta Karlik en Traude Bernert rapporteerden in 1942 de resultaten van hun onderzoek en ze stelden de naam “Viennum” voor. Echter vanwege de Tweede Wereldoorlog bleef het nieuws binnen de Duitse grenzen en kwam er ok geen wetenschappelijk nieuws uit andere delen van de wereld binnen. Karlik en Bernert waren niet op de hoogte van de vergelijkbare resultaten van de Berkeleygroep. Toe ze dat wel waren bleven Karlik en Bernert element 85 bestuderen en ze droegen met hun onderzoek enorm veel bij aan de kennis over de vervalketen van het element.
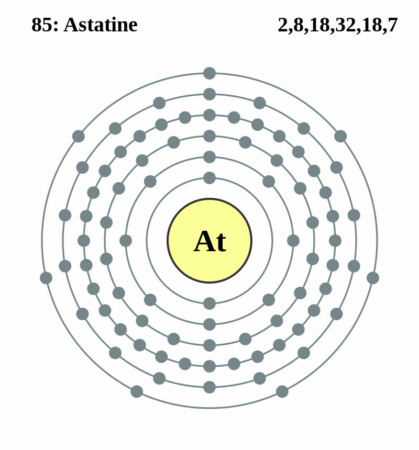
Bohr-Rutherford diagram
Chemische gegevens
| Symbool | At |
| Volledige naam | Astatine |
| Atoomnummer | 85 |
| Atoommassa (g.mol-1 ) | 210 |
| Groep | post-transitiemetaal |
| Elektronegativiteit (Pauling) | 2,2 |
| Dichtheid (g.cm-3 bij 20 °C) | 6,35 |
| Smeltpunt (°C) | 302 |
| Kookpunt (°C) | 337 |
| Vanderwaalsstraal (nm) | 0,202 |
| Ionstraal | — |
| Isotopen | >30 radioactieve isotopen |
| Elektronenschil | [Xe]4f145d106s26p5 |
| Elektronen per schil | 2, 8, 18, 32, 18, 7 |
| Eerste ionisatiepotentiaal (kJ.mol-1 ) | 899 |
| Tweede ionisatiepotentiaal (kJ.mol-1 ) | — |
| Derde ionisatiepotentiaal (kJ.mol-1 ) | — |
| Standaard potentiaal (V) | — |
| Ontdekt door: | Dale R. Corson, Kenneth Ross MacKenzie, Emilio Segré (1940) |
Isotopen
| Nuclide | Isotopische massa (u) | Halfwaardetijd |
|---|---|---|
| 193At | 192,99984 | 28 ms |
| 194At | 193,99873 | ± 40 ms |
| 195At | 194,99626 | 328 ms |
| 196At | 195,99579 | 253 ms |
| 197At | 196,99319 | 0,390 s |
| 198At | 197,99284 | 4,2 s |
| 199At | 198,99053 | 6,92 s |
| 200At | 199,99035 | 43,2 s |
| 201At | 200,98841 | 85 s |
| 202At | 201,98863 | 184 s |
| 203At | 202,98694 | 7,37 min |
| 204At | 203,98725 | 9,2 min |
| 205At | 204,98607 | 26,2 min |
| 206At | 205,98666 | 30,6 min |
| 207At | 206,98578 | 1,80 uur |
| 208At | 207,98659 | 1,63 uur |
| 209At | 208,98617 | 5,41 uur |
| 210At | 209,98714 | 8,1 uur |
| 211At | 210,98749 | 7,214 uur |
| 212At | 211,99074 | 0,314 s |
| 213At | 212,99293 | 125 ns |
| 214At | 213,99637 | 558 ns |
| 215At | 214,99865 | 0,10 ms |
| 216At | 216,00242 | 0,30 ms |
| 217At | 217,00471 | 32,3 ms |
| 218At | 218,00869 | 1,5 s |
| 219At | 219,01116 | 56 s |
| 220At | 220,01541 | 3,71 min |
| 221At | 221,01805 | 2,3 min |
| 222At | 222,02233 | 54 s |
| 223At | 223,02519 | 50 s |
Weetjes
- Astatine is vernoemd naar het Griekse woord “astatos” en dat betekent instabiel
- Er komt slechts 25 gram natuurlijk Astatine in de korst van de Aarde voor.
- Astatine is het zwaarste halogeen dat we kennen. Halogenen zijn niet-metalen, hebben een laag smeltpunt en een laag kookpunt. Als vaste stof zijn ze bros. Het zijn slechte geleiders van warmte en elektriciteit en ze zijn allemaal di-atomisch (hun moleculen bevatten twee atomen).
- Van alle halogenen is Astatine het minst reactief en heeft het de meest metallische eigenschappen.
- Het isotoop met de langste halfwaardetijd is 210 At. Dit isotoop heeft een halfwaardetijd van 8,1 uur.
- Veel eigenschappen van Astatine zijn nog steeds onbekend, Zo weet men niet welke kleur het element heeft. Uitgaande van de kleurenpatronen van de andere halogenen denkt men dat het een donkere stof is, mogelijk zelfs zwart.
- Astatine is hoog radioactief maar desondanks zijn er geen gevaren voor de gezondheid of de omgeving en dat komt doordat het zeer zeldzaam is en de isotopen erg korte halfwaardetijden hebben. Komt iemand toch in contact met Astatine dan kan het element zich ophopen in de schildklier, net zoals Jodium dat doet.
Huidig onderzoek
De schaarste van Astatine is de reden dat het enorm moeilijk is te bestuderen. Desalniettemin denken onderzoekers dat Astatine gebruikt kan worden bij de behandeling van kanker. Astatine kan zich net als Jodium gedragen. Dit heeft de neiging zich op te hopen in de schildklier. Astatine kan dit ook en de straling van het element kan kankercellen in de schildklier doden.
Het radioactieve isotoop 211 At zou ook de efficiëntie kunnen verbeteren van de behandeling van tumoren en andere kankersoorten waarbij de tumorcellen resistent zijn tegen chemotherapie of andere soorten van radioactieve therapie.