Wat is het eindpunt van een titratie?
Inhoudsopgave
Het punt waar de indicator van kleur verandert is het eindpunt van de titratie. Dit wordt altijd aangegeven door de kleurverandering van het reactiemengsel.
Wat is titratie in de chemie?
Titrimetrie is een analytische techniek die een oplossing met een bekende concentratie gebruikt om de concentratie van een onbekende monsteroplossing te bepalen. Bij de titratietechniek wordt een oplossing met een bekende concentratie een titrant genoemd, terwijl een oplossing met een onbekende concentratie een analyt wordt genoemd. Het is een methode voor kwantitatieve chemische analyse, bekend als titrimetrie of volumetrische analyse.
Er zijn verschillende vormen van titrimetrie als het gaat om procedure en doelen, zoals zuur base titraties, redoxtitraties, neerslagtitraties, complexometrische titraties. Zuur- base en redox worden echter het meest gebruikt bij de kwantitatieve chemische titraties.
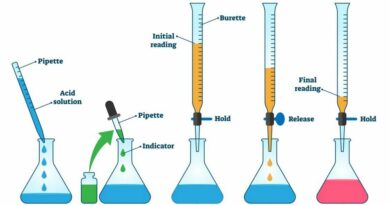
De methode omvat het druppelsgewijs toevoegen van titrant uit een buret aan een erlenmeyer met titrand (het analyt in oplossing) totdat de reactie is voltooid. Er wordt vaak een indicator gebruikt om het eindpunt van de reactie te detecteren. Bij sommige reacties is een indicator niet vereist, aangezien de reactanten as zelfindicator kunnen fungeren, of het eindpunt wordt bepaald via een instrumentele methode.
Wat is de definitie van het eindpunt?
Het eindpunt verwijst naar het punt in het titratieproces waar de kleur van de indicator verandert.
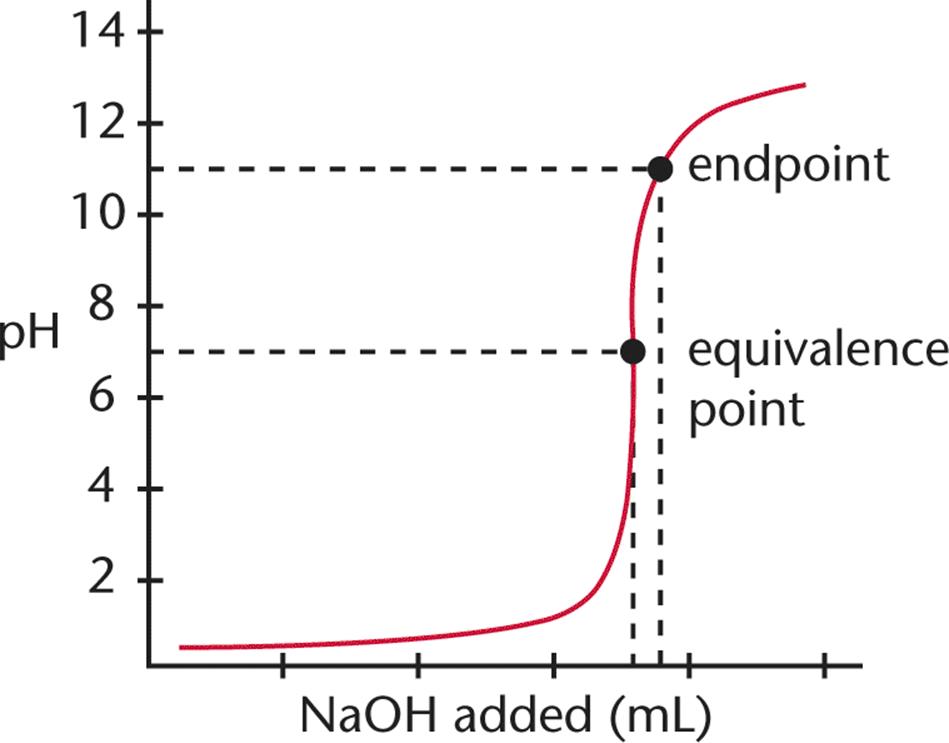
Dit is het punt waarop geen standaardoplossing meer zou moeten worden toegepast. Het kan bijvoorbeeld worden bepaald door een kleurverandering in een indicator of het verschijnen van een neerslag. Bij titraties komt het eindpunt na het equivalentiepunt, het heeft aan dat het equivalentiepunt is bereikt.
Wat is het eindpunt van een titratie?
Het eindpunt in het titratieproces is het punt waarop de kleur van de indicator verandert als gevolg van pH-verandering. Dit gebeurt tijdens de hele titratieprocedure wanneer de titrant en de monsterverbinding worden gemengd.
Het komt met of na het equivalentiepunt en wordt beschouwd als een ideaal punt om de titratie te beëindigen. De indicatoren zullen op dit punt van kleur veranderen en we zullen de metingen kunnen doen om de hoeveelheid van de onbekende analytconcentratie te berekenen.
Zuren en basen zijn bijvoorbeeld meestal kleurloos. Daarom wordt een indicator (bijvoorbeeld fenolftaleïne) gebruikt om de voltooiing van een neutralisatiereactie te bepalen die de kleur (bijvoorbeeld roze) van het reactiemengsel kan veranderen met veranderingen in de pH (bijvoorbeeld neutraal).
Bij titraties zijn niet altijd indicatoren betrokken. Instrumentele methodes worden ook gebruikt om het eindpunt te bepalen, ze werken bij een breed pH-bereik en leveren snelle en nauwkeurige resultaten op. Voorbeelden van dergelijke apparatuur zijn een pH-meter, autotitrator, geleidbaarheidsmeter, potentiometer, Karl Fisher en isothermische titratie, etc.
Wat zijn het equivalentiepunt en het eindpunt van een titratie?
In de chemie zijn het equivalentiepunt en het eindpunt beide belangrijke fase die worden bereikt tijdens het uitvoeren van een titratie-experiment. De meerderheid van de mensen denkt dat ze hetzelfde zijn, maar dat is niet zo.
In het titratieproces is het equivalentiepunt het punt waar de chemische reactie in het titratiemengsel eindigt, terwijl het eindpunt het punt is waar de indicator van kleur verandert om aan te geven dat de titratie is voltooid. Het equivalentiepunt wordt niet altijd aangegeven door een verandering in de kleur van de oplossing en het eindpunt wordt altijd aangegeven door een verandering in de kleur van de oplossing.
Eerste publicatie: 26 maart 2023