Aminozuren
Inhoudsopgave
De eiwitten waaruit levende organismes bestaan zijn enorme moleculen. Maar die moleculen zijn opgebouwd uit kleine bouwstenen, de aminozuren. In de natuur worden meer dan 500 aminozuren gevonden maar hiervan worden er door het menselijke DNA slechts 20 rechtstreeks gemaakt. Elk eiwit in ons lichaam bestaat uit een gekoppelde combinatie van deze aminozuren. In dit artikel gaan we nader in op deze aminozuren.
Grofweg kunnen deze 20 aminozuren onderverdeeld worden in twee groepen: essentiële en niet-essentiële aminozuren. Niet-essentiële aminozuren zijn die aminozuren die het menselijk lichaam zelf kan maken. De essentiële aminozuren moeten uit voedsel worden gehaald. De niet-essentiële aminozuren zijn alanine, arginine, asparagine, asparaginezuur, cysteïne, glutaminezuur, glycine, proline, serine en tyrosine. Sommigen hiervan kunnen “conditioneel niet-essentieel” worden genoemd en dat betekent dat ze tijdens ziekte of als gevolg van gezondheidsproblemen nodig kunnen zijn uit onze voeding. Deze subcategorie omvat arginine, glycine, cysteïne, tyrosine, proline en glutamine. De essentiële aminozuren tenslotte zijn histidine, isoleucine, leucine, lysine, methionine, fenylalanine, threonine, tryptofaan en valine.
Aminozuren kunnen niet op dezelfde manier als vetten in het lichaam worden opgeslagen. Het is dus belangrijk dat we de benodigde aminozuren binnenkrijgen dien we niet uit ons eten kunnen maken. Als dit niet lukt dan kan dit leiden tot remmingen in de aanmaak van eiwitten in het lichaam en dat kan in een later stadium weer leiden tot een heel scala aan gezondheidseffecten. Aminozuren worden verkregen uit de afbraak van eiwitten in het dieet dus een eiwitarm dieet kan van invloed zijn op de inname van essentiële aminozuren.
Omdat de eiwitten die door aminozuren worden gemaakt ongelooflijk grote moleculen kunnen zijn zou het erg tijdrovend en moeilijk zijn om de chemische structuur ervan op dezelfde manier te tekenen als voor kleinere moleculen. Om deze reden krijgen de gemeenschappelijke aminozuren waaruit eiwitten bestaan codes die kunnen worden gebruikt om ze weer te geven wanneer ze in moleculen voorkomen en zo het beschrijven van de structuur van eiwitten gemakkelijker te maken, er zijn zowel éénletter- als drielettercodes. De oorsprong van de éénlettercodes was te wijten aan de eis, toen computers ouder en onhandiger waren, om de grootte van bestanden te verminderen die worden gebruikt om de sequenties van aminozuren die eiwitten vormen, te beschrijven. De éénlettercodes zijn ontwikkeld door Dr. Oakly Dayhoff, een autoriteit op het gebied van bio-informatica.
Hoewel onderstaande tabel de 20 aminozuren toont waardoor ons lichaam de genetische code direct codeert is er enige discussie geweest over het al dan niet classificeren van een ander aminozuur als het 21ste. Selenocysteïne is een aminozuur dat in een klein aantal menselijke eiwitten wordt aangetroffen. In tegenstelling tot de hier genoemde 20 is het echter niet direct gecodeerd maar op een speciale manier. Nog een ander, pyrrolysine, wordt op een vergelijkbare manier gecodeerd en het wordt ook wel als het 22ste aminozuur beschouwd.
Aminozuren kunnen ook nog ingedeeld worden op hun fysieke eigenschappen.
De structuur van aminozuren
Alle 20 algemene aminozuren zijn α-aminozuren. Ze bevatten een carboxylgroep, een aminogroep en een zijketen (R-groep) die allemaal zijn bevestigd aan de α-koolstof.
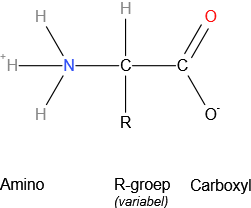
Uitzonderingen:
- Glycine heeft geen zijketen. Zijn α-koolstof heeft twee waterstoffen.
- Proline, waarvan het stikstof deel is van een ring.
Ieder aminozuur heeft dus een aminegroep aan het ene einde en een zuurgroep aan het andere einde en een onderscheidende zijketen. De ruggengraat is voor alle aminozuren identiek maar de zijketen verschilt van aminozuur tot aminozuur.
Alle aminozuren met uitzondering van glycine komen voor in de L-configuratie aangezien voor alle aminozuren op één na het α-koolstof een asymmetrisch koolstof is. Omdat glycine geen asymmetrisch koolstofatoom bevat is het niet optisch actief en is het dus noch D noch L.
Classificatie van aminozuren op basis van de R-groep
- Niet polaire, alifatische aminozuren: de R-groepen in deze klasse van aminozuren zijn niet-polair en hydrofoob. Het zijn de aminozuren glycine, alanine, valine, leucine, isoleucine, methionine en proline.
- Aromatische aminozuren: de aromatische zijketens zijn relatief niet-polair (hydrofoob. Ze kunnen allemaal deelnemen aan hydrofobe interacties. Het zijn de aminozuren fenylalanine, tyrosine en tryptofaan.
- Polaire, ongeladen aminozuren: de R-groepen van deze aminozuren zijn beter oplosbaar in water oftewel hydrofiel, dan de niet-polaire aminozuren. Ze bevatten namelijk functionele groepen die waterbindingen vormen met water. Tot deze klasse van aminozuren behoren serine, threonine, cysteïne, asparagine en glutamine.
- Acidische aminozuren: de R-groep is acidisch oftewel negatief geladen. Het zijn de aminozuren glutaminezuur en asparaginezuur.
- Basische aminozuren: de R-groep is basisch oftewel positief geladen. Dit zijn de aminozuren lysine, arginine en histidine.
Classificatie van aminozuren op basis van voeding
Essentiële aminozuren
Er zijn 9 aminozuren die niet door het lichaam aangemaakt kunnen worden en daarom voor het maken van eiwitten aanwezig moeten zijn in het opgenomen voedsel. Het zijn de aminozuren histidine, isoleucine, lysine, methionine, fenylalanine, threonine, tryptofaan en valine.
Niet-essentiële aminozuren
Er zijn 5 aminozuren die door het lichaam zelf aangemaakt kunnen worden en derhalve niet noodzakelijkerwijs in de opgenomen voeding aanwezig moeten zijn. Het zijn de aminozuren alanine, asparagine, asparaginezuur, glutaminezuur en serine.
Conditioneel niet-essentiële aminozuren
Er zijn 6 conditioneel niet-essentiële aminozuren. Dit zijn aminozuren die onder bepaalde omstandigheden niet voldoende in het lichaam aangemaakt kunnen worden waardoor er behoefte is om dit vanuit de voeding aan te vullen. Het zijn de aminozuren arginine, cysteïne, glutaminezuur, glycine, proline en tyrosine.
Eigenschappen van aminozuren
Fysische eigenschappen
- Aminozuren zijn kleurloze, kristallijne vaste stoffen.
- Alle aminozuren hebben een smeltpunt > 200 °C.
- Aminozuren zijn oplosbaar in water en lossen slecht op in methanol, ethanol en propanol. De R-groep van de aminozuren en de pH van het oplosmiddel spelen een belangrijke rol in de oplosbaarheid.
- Aminozuren ontleden bij verhitting tot hoge temperaturen.
- Alle aminozuren, op glycine na, zijn optisch actief.
- Aminozuren kunnen peptidebindingen aan gaan waarbij amino- en carboxylaatgroepen zijn betrokken. Er wordt een covalente binding gevormd tussen de alfa-aminogroep van het ene aminozuur en een alfa-carboxylgroep van een ander. Hieruit ontstaat een -CO-NH-binding. Peptidebindingen zijn vlak en gedeeltelijk ionisch.
Chemisch eigenschappen
Zwitterionogene eigenschappen
Een zwitter-ion is een molecuul met functionele groepen waarvan er tenminste eentje een positieve lading heeft en een andere een negatieve lading heeft. De netto lading van het gehele molecuul is nul. Amonizuren zijn de best bekende voorbeelden van zwitter-ionen. Ze bevatten en amine-groep (basisch) en een carboxylgroep (acidisch). De -NH2-groep is de sterkere base en neemt dus H+ op van de COOH-groep waarbij er een zwitter-ion ontstaat. Het (neutrale) zwitter-ion is de gebruikelijke vorm waarin aminozuren in oplossing voorkomen.
Amfotere eigenschappen
Aminozuren zijn van nature amfoteer. Dat wil zeggen dat ze zowel als zuur en als base reageren en dat heeft te maken met de amine- en carboxylgroepen die aanwezig zijn.
De Ninhydrine test
Als je 1 ml van een ninhydrine-oplossing toevoegt aan een 1 ml eiwitoplossing en die dan verhit dan wijst het ontstaan van een paarse kleur op de aanwezigheid van alfa-aminozuren.
Xanthoproteïne test
De xanthoproteïne test wordt uitgevoerd om aromatische aminozuren aan te tonen (tyrosine, tryptofaan en fenylalanine) in een eiwitoplossing. De nitrering van benzoëradicalen die aanwezig zijn in de aminozuurketen vindt plaats door reactie met salpeterzuur waardoor de oplossing een gele kleur krijgt.
Reactie met Sanger’s reagent
Sanger’s reagens (1-fluoro-2,4-dinitrobenzeen) reageert onder licht alkalische en koude condities met een vrije aminogroep in de peptideketen.
Reactie met salpeterzuur
Salpeterzuur reageert met de aminogroep. Hierbij komt stikstof vrij en het bijbehorende hydroxyl.
Gegevens aminozuren
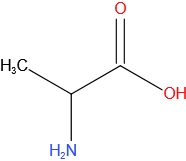
Alanine
Gegevens
| Molecuulformule | C3H7NO2 |
| IUPAC-naam | 2-aminopropaanzuur |
| Molmassa (g*mol-1) | 89,09 |
| CAS-nummer | 56-41-7 |
| Kleur | wit |
| Drielettercode | Ala |
| DNA codon | GCT, GCC, GCA, GCG |
Structuurformule
Glycine
Gegevens
| Molecuulformule | C2H5NO2 |
| IUPAC-naam | 2-amino-ethaanzuur |
| Molmassa (g*mol-1) | 75,07 |
| CAS-nummer | 56-40-6 |
| Kleur | kleurloos – wit |
| Drielettercode | GLY |
| DNA codon | GGT, GGC, GGA, GGG |
Structuurformule

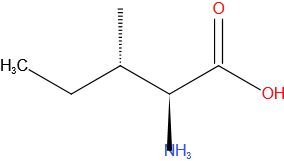
Isoleucine
Gegevens
| Molecuulformule | C6H13NO2 | |
| IUPAC-naam | (2S,3S)-2-Amino-3-methylpentaanzuur | |
| Molmassa (g*mol-1) | 131,18 | |
| CAS-nummer | 73-32-5 | |
| Kleur | kleurloos | |
| Drielettercode | Ile | |
| DNA codon | ATT, ATC, ATA | |
Structuurformule
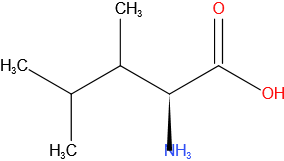
Leucine
Gegevens
| Molecuulformule | C6H13NO2 |
| IUPAC-naam | (S)-2-amino-4-methyl-pentaan-1-zuur |
| Molmassa (g*mol-1) | 131,18 |
| CAS-nummer | 61-90-5 |
| Kleur | kleurloos |
| Drielettercode | Leu |
| DNA codon | CTT, CTC, CTA, CTG, TTA, TTG |
Structuurformule
Proline
Gegevens
| Molecuulformule | C5H9NO2 |
| IUPAC-naam | (S)-pyrrolidine-2-carbonzuur |
| Molmassa (g*mol-1) | 115,13 |
| CAS-nummer | 147-85-3 |
| Kleur | transparante kristallen |
| Drielettercode | Pro |
| DNA codon | CCT, CCC, CCA, CCG |
Structuurformule
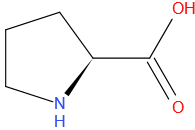
Valine
Gegevens
| Molecuulformule | C5H11NO2 |
| IUPAC-naam | (S)-2-amino-3-methyl-butaanzuur |
| Molmassa (g*mol-1) | 117,15 |
| CAS-nummer | 72-18-4 |
| Kleur | wit |
| Drielettercode | Val |
| DNA codon | GTT, GTC, GTA, GTG |
Structuurformule
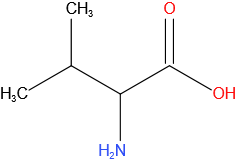
Fenylalanine
Gegevens
| Molecuulformule | C9H11NO2 |
| IUPAC-naam | 2-amino-3-fenylpropaanzuur |
| Molmassa (g*mol-1) | 165,19 |
| CAS-nummer | 63-91-2 |
| Kleur | wit |
| Drielettercode | Phe |
| DNA codon | TTT, TTC |
Structuurformule
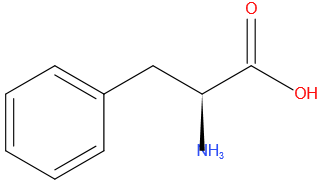
Tryptofaan
Gegevens
| Molecuulformule | C11H12N2O2 |
| IUPAC-naam | (S)-2amino-3-(1H-indol-3-yl)-propaanzuur |
| Molmassa (g*mol-1) | 204,225 |
| CAS-nummer | 73-22-3 |
| Kleur | wit-lichtgeel |
| Drielettercode | Trp |
| DNA codon | TGG |
Structuurformule
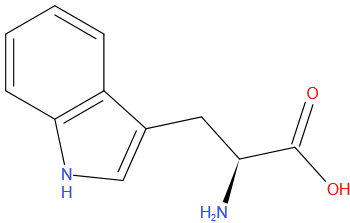
Tyrosine
Gegevens
| Molecuulformule | C9H11NO3 |
| IUPAC-naam | Tyrosine |
| Molmassa (g*mol-1) | 181,19 |
| CAS-nummer | 60-18-4 |
| Kleur | wit |
| Drielettercode | Tyr |
| DNA codon | TAT, TAC |
Structuurformule

Asparaginezuur
Gegevens
| Molecuulformule | C4H7NO4 |
| IUPAC-naam | (2S)-aminobutaanzuur |
| Molmassa (g*mol-1) | 133,10 |
| CAS-nummer | 56-84-8 |
| Kleur | kleurloos |
| Drielettercode | Asp |
| DNA codon | GAT, GAC |
Structuurformule
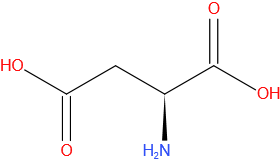
Glutaminezuur
Gegevens
| Molecuulformule | C5H9NO4 |
| IUPAC-naam | 2-aminopentaandizuur |
| Molmassa (g*mol-1) | 147,13 |
| CAS-nummer | 56-86-0 |
| Kleur | wit |
| Drielettercode | Glu |
| DNA codon | GAA, GAG |
Structuurformule

Arginine
Gegevens
| Molecuulformule | C6H14N4O2 |
| IUPAC-naam | (2S)-2-amino-5-(diaminomethylideenamino)pentaanzuur |
| Molmassa (g*mol-1) | 174,20 |
| CAS-nummer | 74-79-3 |
| Kleur | wit |
| Drielettercode | Arg |
| DNA codon | CGT, CGC, CGA, CGG, AGA, AGG |
Structuurformule

Histidine
gegevens
| Molecuulformule | C6H9N3O2 |
| IUPAC-naam | Histidine |
| Molmassa (g*mol-1) | 155.55 |
| CAS-nummer | 71-00-1 |
| Kleur | kleurloos |
| Drielettercode | His |
| DNA codon | CAT, CAC |
structuurformule

Lysine
Gegevens
| Molecuulformule | C6H14N2O2 |
| IUPAC-naam | Lysine |
| Molmassa (g*mol-1) | 146,188 |
| CAS-nummer | 56-87-1 |
| Kleur | wit |
| Drielettercode | Lys |
| DNA codon | AAA, AAG |
Structuurformule
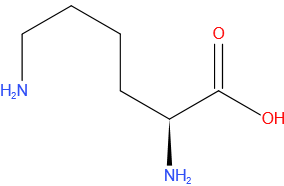
Serine
Gegevens
| Molecuulformule | C3H7NO3 |
| IUPAC-naam | β-hydroxyalanine |
| Molmassa (g*mol-1) | 105,09 |
| CAS-nummer | 56-45-1 |
| Kleur | wit |
| Drielettercode | Ser |
| DNA codon | TCT, TCC, TCA, TCG, AGT, AGC |
Stuctuurformule

Threonine
Gegevens
| Molecuulformule | C4H9NO3 |
| IUPAC-naam | 2-amino-3-hydroxybutaanzuur |
| Molmassa (g*mol-1) | 119,12 |
| CAS-nummer | 72-19-5 |
| Kleur | kleurloos |
| Drielettercode | Thr |
| DNA codon | ACT, ACC, ACA, ACG |
Structuurformule
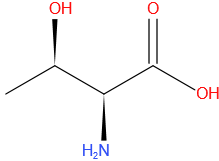
Cysteïne
Gegevens
| Molecuulformule | C3H7NO2S |
| IUPAC-naam | (2R)-2-amino-3-sulfanylpropaanzuur |
| Molmassa (g*mol-1) | 121,158 |
| CAS-nummer | 52-90-4 |
| Kleur | kleurloos |
| Drielettercode | Cys |
| DNA codon | TGT, TGC |
Structuurformule
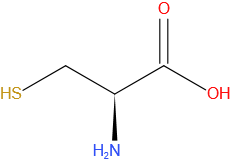
Methionine
Gegevens
| Molecuulformule | C5H11NO2S |
| IUPAC-naam | (S)-2-amino-4-(methylsulfanyl)-butaanzuur |
| Molmassa (g*mol-1) | 149,21 |
| CAS-nummer | 63-68-3 |
| Kleur | wit |
| Drielettercode | Met |
| DNA codon | ATG |
Structuurformule

Asparagine
Gegevens
| Molecuulformule | C4H8N2O3 |
| IUPAC-naam | (2S)-2,4-diamino-4-oxobutaanzuur |
| Molmassa (g*mol-1) | 132,12 |
| CAS-nummer | 70-47-3 |
| Kleur | wit |
| Drielettercode | ASN |
| DNA codon | AAT, AAC |
Structuurformule
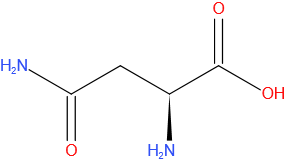
Glutamine
Gegevens
| Molecuulformule | C5H10N2O3 |
| IUPAC-naam | 2-amino-4-carbamoylbutaanzuur |
| Molmassa (g*mol-1) | 146,14 |
| CAS-nummer | 56-85-9 |
| Kleur | kleurloos |
| Drielettercode | Gln |
| DNA codon | CAA, CAG |
Structuurformule

